“La relación estructura/actividad de proteínas en ambientes molecularmente superpoblados”. Dra Verónica Nolan
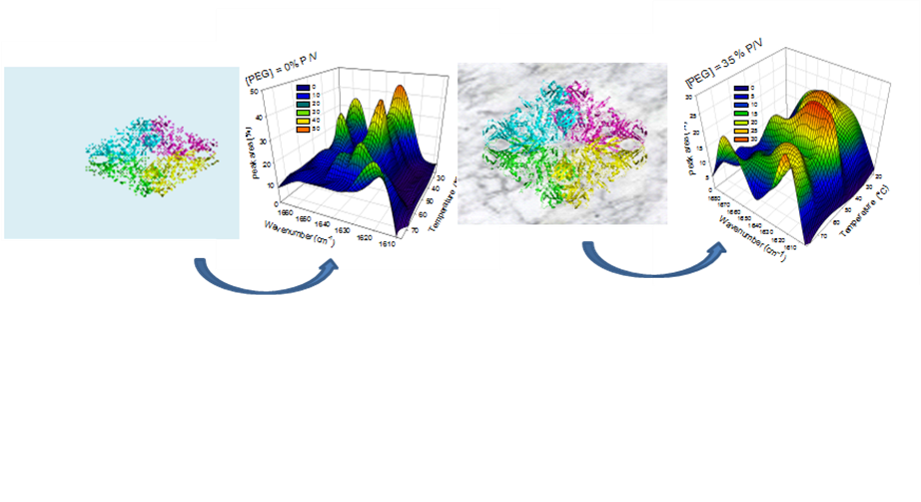
El citoplasma celular está compuesto de diferentes especies moleculares como proteínas, ribosomas y ácidos nucleicos entre otras que generan en conjunto un ambiente superpoblado. Las macromoléculas ocupan una importante fracción de volumen que no puede ser ocupado por otras moléculas. Además, el citoesqueleto genera una red tridimensional donde las moléculas quedan confinadas. Como consecuencia de esto, las moléculas son sometidas a restricciones estéricas y difusionales que afectan sus propiedades. La actividad termodinámica de las diferentes macromoléculas presentes en el sistema se incrementa varios órdenes de magnitud en un ambiente superpoblado con respecto a una solución diluida. Por otro parte, las velocidades de difusión se encuentran reducidas. La teoría de volumen de exclusión predice que la superpoblación molecular tendrá efecto sobre el plegamiento de la proteína estabilizando el estado nativo. La actividad enzimática puede entonces estar afectada por cambios en la conformación de la proteína debidos a la superpoblación molecular. Los ambientes superpoblados se caracterizan por presentar grandes superficies en contacto con el solvente, lo cual afecta su estructura. Esto puede afectar el plegamiento de la proteína y a través de ese mecanismo la actividad enzimática. La estructura del agua además puede modificar la cinética de una enzima por afectar la interacción hidrofóbica enzima-sustrato. Mi trabajo de investigación intenta contribuir a la comprensión de la modulación de la relación estructura/función de proteínas confinadas en ambientes que simulan condiciones de superpoblación molecular. La proteína que utilizo como modelo es una beta-galactosidasa (beta-Gal), enzima que cataliza la hidrólisis de lactosa en glucosa y galactosa. Para simular condiciones de superpoblación molecular se utilizan altas concentraciones de polímeros hidrofílicos como polietilen glicol (PEG).