BBM
ESTABILIDAD, ESTRUCTURA Y ACTIVIDAD DE PROTEÍNAS Y EL EFECTO DEL ENTORNO. Dra Inés Burgos
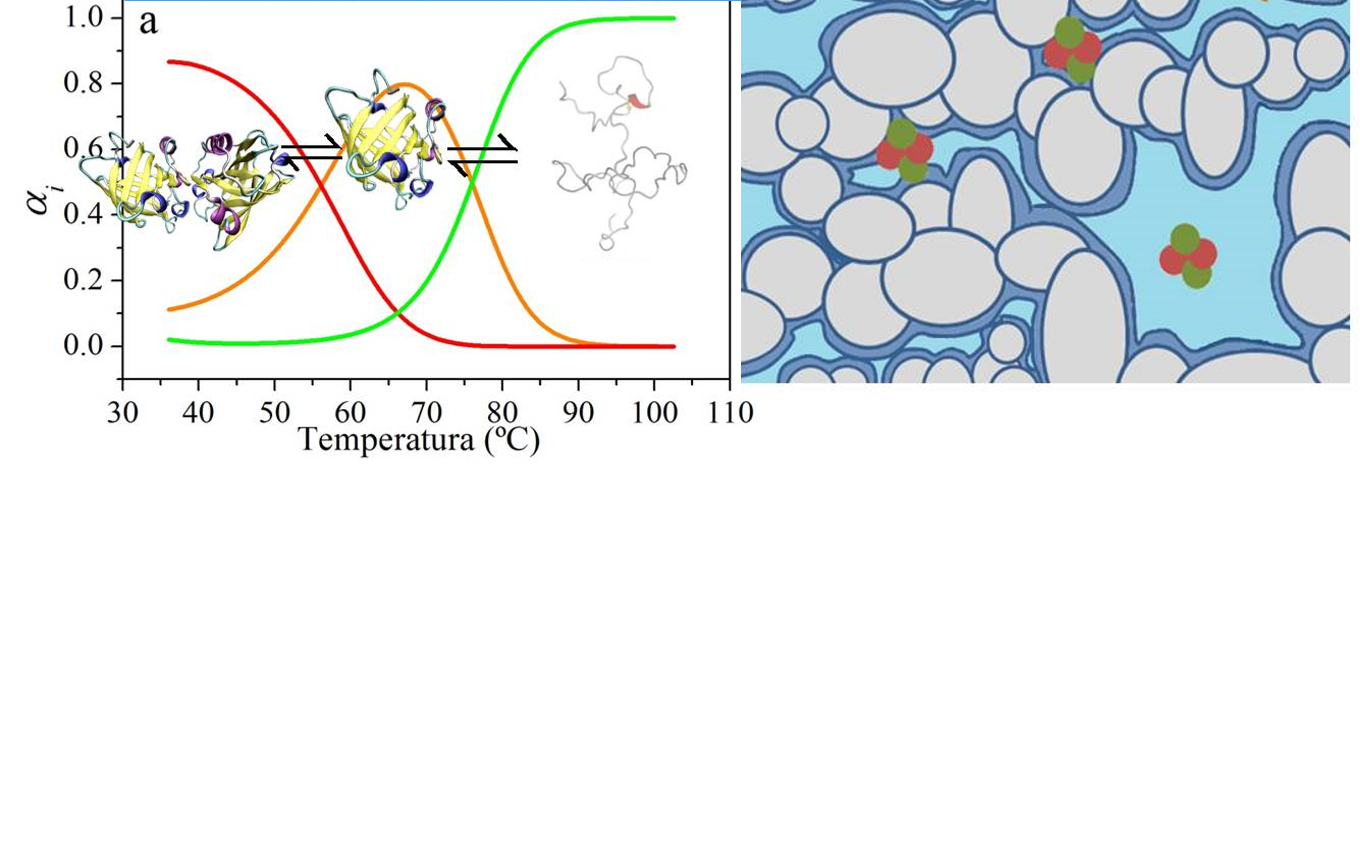
La interacción de las proteínas con otras moléculas o con un entorno fuera de las condiciones ideales (soluciones diluidas), produce efectos sobre su estabilidad, estructura y actividad. Los efectos sobre la estabilidad térmica pueden estudiarse mediante experimentos de calorimetría diferencial de barrido (DSC) los cuales pueden ser racionalizados a través de modelos termodinámicos. Se mostrarán los cambios en la termoestabilidad de proteínas por el proceso de homo-oligomerización predichos por diferentes modelos termodinámicos y los cambios en estabilidad y estructura de la b-Lactoglobulina por el proceso de dimerización, observados por DSC y por espectroscopia de infrarrojo (FT-IR). Se discutirán los resultados obtenidos en el estudio del efecto de la modulación del entorno sobre la actividad enzimática de proteínas confinadas, en particular b-Galactosidasa (b-Gal) encapsulada en una matriz de silicato nano porosa. La caracterización de las propiedades de la matriz y de las características del agua en ambientes nanométricos permite entender los cambios en la capacidad de catalizar la hidrólisis de diferentes sustratos.